La comprensión de los elementos químicos y sus propiedades es fundamental en el estudio de la química.
Una de las características más importantes de un elemento es el número de protones que posee en su núcleo.
Saber cómo determinar la cantidad de protones de un elemento puede ser una tarea compleja para aquellos que no están familiarizados con la química.
Sin embargo, en esta guía práctica y sencilla, te brindaremos los conocimientos necesarios para identificar fácilmente el número de protones de cualquier elemento.
Acompáñanos en este recorrido por el mundo de la tabla periódica y descubre cómo desentrañar uno de los secretos más fascinantes de la química.
Saber los protones de un elemento
Saber los protones de un elemento es fundamental para comprender su naturaleza y sus propiedades.
Los protones son partículas subatómicas con carga positiva que se encuentran en el núcleo de un átomo.
Son uno de los tres componentes básicos de un átomo, junto con los neutrones y los electrones.
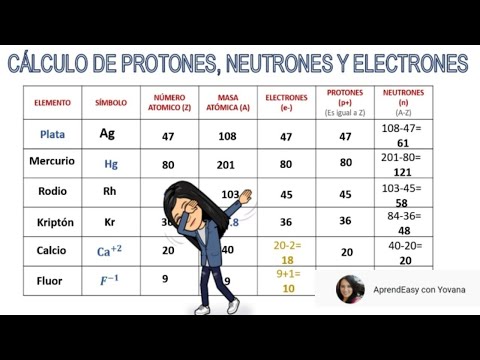
Para determinar el número de protones de un elemento, se utiliza la tabla periódica de los elementos.
Cada elemento tiene un número atómico único, que representa la cantidad de protones en su núcleo.
Este número se encuentra en la esquina superior izquierda de la celda del elemento en la tabla periódica.
Por ejemplo, el hidrógeno tiene un número atómico de 1, lo que significa que tiene un solo protón en su núcleo.
El helio, por su parte, tiene un número atómico de 2, lo que indica que tiene dos protones en su núcleo.
Es importante destacar que el número de protones de un elemento determina su identidad química.
Dos elementos con diferente número de protones son elementos distintos y tienen propiedades diferentes.
Por ejemplo, el carbono tiene 6 protones, mientras que el oxígeno tiene 8 protones.
El conocimiento del número de protones de un elemento también permite determinar su masa atómica.
Los protones y los neutrones tienen masa similar, por lo que la suma de los protones y neutrones en el núcleo de un átomo nos dará la masa atómica aproximada del elemento.
Los electrones, por otro lado, tienen una masa mucho menor y no contribuyen significativamente a la masa total del átomo.
Significado de la P+ en la tabla periódica
La P+ en la tabla periódica se refiere a los elementos químicos que tienen un número atómico mayor a 84.
Estos elementos se conocen como elementos superpesados.
La P+ proviene de la palabra “pesado” y el símbolo “+” indica que estos elementos tienen una carga positiva en su núcleo.
Los elementos superpesados son extremadamente raros y se producen principalmente en laboratorios a través de reacciones nucleares.
Son altamente inestables y se descomponen rápidamente, lo que dificulta su estudio y caracterización.
Algunos ejemplos de elementos superpesados son el plutonio (Pu), el americio (Am) y el curio (Cm).
Estos elementos tienen aplicaciones en la industria nuclear, la medicina y la investigación científica.
La P+ en la tabla periódica es una categoría especial que representa a estos elementos únicos y poco comunes.
Estudiar y comprender las propiedades de los elementos superpesados es un desafío para los científicos, pero también puede tener importantes implicaciones en el desarrollo de nuevas tecnologías y el avance de la ciencia.
Organización de partículas en la tabla periódica
La tabla periódica es una herramienta fundamental en la química, ya que organiza y clasifica los elementos químicos según sus propiedades y características.
La estructura de la tabla periódica se basa en la organización de las partículas que conforman los átomos de los elementos.
En la tabla periódica, los elementos se encuentran dispuestos en filas horizontales llamadas periodos y en columnas verticales conocidas como grupos o familias.
Los periodos están numerados del 1 al 7, mientras que los grupos están numerados del 1 al 18.
Los elementos en la tabla periódica se organizan de forma ascendente según su número atómico, es decir, la cantidad de protones que posee su núcleo.
El número atómico define la identidad del elemento y determina su posición en la tabla periódica.
Cada elemento químico está representado por un símbolo que generalmente consiste en una o dos letras.
Por ejemplo, el símbolo del hidrógeno es H, del oxígeno es O y del carbono es C.
Estos símbolos son utilizados para abreviar el nombre completo del elemento y facilitar su representación en la tabla periódica.
Dentro de cada elemento, las partículas se organizan en niveles de energía o capas electrónicas.
Los niveles de energía se representan mediante números y se denominan K, L, M, N, O, P y Q.
El nivel K es el más cercano al núcleo y posee una capacidad máxima de 2 electrones, mientras que los demás niveles tienen una capacidad máxima de 8 electrones.
En cada nivel de energía, los electrones se distribuyen en orbitales.
Los orbitales son regiones del espacio alrededor del núcleo donde se puede encontrar a los electrones.
Los orbitales se representan mediante letras y números, como por ejemplo 1s, 2p, 3d, 4f, entre otros.
Los electrones en los átomos se distribuyen de acuerdo con el principio de Aufbau, que establece que los electrones ocupan los orbitales de menor energía primero antes de llenar los de mayor energía.
Esto significa que los electrones llenan los orbitales en un orden específico, siguiendo una secuencia determinada.
La distribución electrónica de un elemento se representa mediante una notación especial que indica la cantidad de electrones en cada nivel y orbital.
Por ejemplo, la distribución electrónica del oxígeno es 1s² 2s² 2p⁴, lo que significa que tiene 2 electrones en el nivel K, 2 en el nivel L y 4 en el nivel M.
¡Descubre los protones de cualquier elemento fácilmente!